
Кристалл искусственного кварца. Его выращивают, поместив в расплав окиси
|
Содержание сайта =>> Популярно о науке =>> Физика |
«Наука и жизнь» 2003 г. № 12,
http://nauka.relis.ru/05/0312/05312038.htm
БЕСЕДЫ ОБ ОСНОВАХ НАУК
Окончание. Начало и продолжение см. «Наука и жизнь» 2003 г. №№ 10, 11
 |
|
Кристалл искусственного кварца. Его выращивают, поместив в расплав окиси
|
ИЗ ЧЕГО ВСЁ СОСТОИТ
Доктор физико-математических наук М. Каганов
КАК ПОСТРОЕНА ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА
Основное состояние любой физической системы – состояние с наименьшей возможной
энергией. Именно возможной! Когда
Нам предстоит понять, как распределены электроны по состояниям в атоме, электронная оболочка которого имеет несколько электронов (в тяжёлых атомах их довольно много).
Общий принцип таков: энергия электронов должна быть наименьшей, но нарушать принцип Паули нельзя.
Для описания состояния электронов в атомах приняты следующие обозначения.
Если у электрона орбитальное квантовое число l = 0, его состояние обозначается буквой s, если l = 1, буквой p, если l = 2, буквой d, наконец, если l = 3, то буквой f. Буквы эти попали в атомную физику из спектроскопии, где они суть первые буквы названия спектральных серий: s – sharp – резкая, p – principal – главная, d – diffuse – диффузная, f – fundamental – фундаментальная.
В атомной физике эти названия, похоже, забыты и остались только буквы. Воспользуемся ими.
При таблице Менделеева есть клеточка, в которой объясняются принятые термины. Среди них имеется строка Электронная конфигурация. На ней зафиксировано распределение электронов по состояниям. Попробуем в ней разобраться.
Энергия электрона в атоме очень слабо зависит от проекций орбитального l и спинового s
моментов на ось квантования. Когда эти зависимости проявляются, то их называют тонкой и сверхтонкой структурой. Во
многих случаях влиянием
Выпишем электронные конфигурации первых нескольких атомов (Z – число электронов в атоме).
Водород (H), Z = 1: 1s 1.
Гелий (He), Z = 2: 1s 2.
Литий (Li), Z = 3: 1s 2 2s 1.
…………………………
Углерод (C), Z = 6:
Что означают латинские буквы, мы уже знаем. Цифры на строке – значения n, а цифра над
строкой – число электронов в состоянии с указанными слева значениями n и l. Итак: у
водорода один электрон в состоянии с n = 1 и l = 0, у гелия два электрона в
таком же состоянии, а у лития два электрона всё в том же состоянии, а третий в состоянии с
n = 2 и l = 0. Третий электрон не попал в состояние 1s
Глядя на обозначение электронной конфигурации, нетрудно представить себе форму электронной оболочки атома. Когда у
всех электронов l = 0, оболочка сферически симметрична. Если в оболочке есть электроны с
l = 1, электронная оболочка вытянута. Присмотритесь к электронной конфигурации углерода.
У него два электрона в
| Развернуть в новом окне: 1512 × 969 px, 201 кбт. | |
 |
|
|
Таблица Менделеева. В левой колонке даны схемы заполнения электронных оболочек атомов по периодам.
Они же приводятся в клетках рядом с символом элемента. Например, криптон Kr имеет два электрона в
|
По своим свойствам атомы существенно отличаются друг от друга. Пытаясь понять, чем вызвано различие их химических свойств, почему одни атомы легко объединяются с другими, а иные инертны, античные философы наградили атомы различными специальными приспособлениями: крючочками, петельками и т. п. Но в атомах нет ничего, кроме ядра и электронов. Именно электроны ответственны за химические свойства веществ и их разнообразие.
Тонкости химических свойств веществ очень непросто строго объяснить, основываясь на понимании электронных структур атомов и конструкций из атомов. Этим занимается специальная наука – квантовая химия, успехи которой велики.
Сосредоточим своё внимание на трёх столбцах таблицы Менделеева – на восьмом, в котором инертные газы, и на двух соседних – на седьмом, где типичные металлоиды (фтор, хлор и т. д.), и на столбце I a, где щелочные металлы (литий, калий, …, а также водород). Восьмой столбец часто помещают перед первым, так что мы не очень погрешили против истины, назвав столбец I a соседним с восьмым. Электронные структуры атомов этих столбцов помогут, по крайней мере в общих чертах, объяснить их свойства.
Вспомним, что квантовое число n определяет «положение» электрона относительно ядра. Чем n больше, тем электрон дальше от ядра. Слово «положение» взято в кавычки, прежде всего, потому, что электрон движется, а, кроме того, как мы говорили, электрон «размазан». И всё же, чем больше n, тем этот движущийся и «размазанный» по своей оболочке электрон дальше от ядра. С ростом величины момента l энергия электрона, как правило, тоже растёт. Водород – исключение: энергия электрона в атоме водорода от l не зависит вовсе.
Электронная конфигурация атомов восьмой группы показывает, что электроны этих атомов необычайно компактно укомплектованы. Ни на один из занятых уровней нельзя добавить ни одного электрона, так как такое добавление вступит в противоречие с принципом Паули. Вот у атомов седьмой группы явно есть одно свободное место, а у всех щелочных металлов есть как бы дополнительный электрон – электрон с максимальной энергией. Он слабее связан с ядром, чем остальные электроны.
Перечисленных сведений об электронной структуре атомов хватит, чтобы пояснить,
КАК ИЗ АТОМОВ ОБРАЗУЮТСЯ МОЛЕКУЛЫ
Когда атомы сближаются друг с другом и их электронные оболочки почти соприкасаются, то может произойти такая перестройка электронных конфигураций атомов, что энергия всей системы несколько уменьшится. При этом возникает связанное состояние сблизившихся атомов. Это и есть молекула.
Разнообразие молекул безгранично. Есть молекулы, состоящие из двух атомов, а есть, по атомным масштабам, огромные конгломераты атомов. Ввели даже специальный термин – «макромолекулы». Сколь бы ни были разнообразны молекулы, сколь бы ни были различны их свойства, любая молекула состоит из ядер, ранее принадлежавших атомам, из которых молекула построена, и электронов, создавших новую по сравнению с исходными атомами электронную оболочку.
В большинстве случаев перестройка электронной конфигурации затрагивает электроны, которые имеют в атоме наибольшую энергию и слабее других связаны со своим ядром. Их называют валентными (термин происходит от латинского слова valentia, что означает «сила»: валентные электроны – носители силы, объединяющей атомы в молекулы).
Нет возможности описать подробно структуру разных молекул. Рассмотрим только простейшие – молекулу
Молекула водорода. Два протона (ядра атомов водорода) создают вокруг себя притягивающее электроны силовое поле. Вокруг ядер движутся два электрона. Оба они имеют наименьшую из возможных энергий, а их спины расположены антипараллельно. Поэтому принцип Паули не нарушен.
Подчеркнем: третьему электрону нет места в том состоянии, в котором находятся два электрона. Возникновение полностью заполненной электронной конфигурации в результате объединения валентных электронов нескольких атомов – часто встречающийся способ образования молекул.
Электроны, близко расположенные к ядру в атоме, в процессе объединения атомов в молекулу играют меньшую роль. Правда, они экранируют заряд ядра, поэтому в многоэлектронном атоме силовое поле, притягивающее валентные электроны, создают уже не ядра, а ионы. Заряд иона тем больше, чем больше в атоме валентных электронов.
Можно было бы подумать, что молекула водорода тождественна атому, ядро которого состоит из двух нуклонов, –
дейтерию. Это не так: атомное расстояние между протонами в молекуле водорода порядка одной десятой нанометра,
а между нуклонами в ядре дейтерия – в 100 тысяч раз меньше.
|
|
 |
||||||||||||||||
|
Состояние электрона в атоме можно описать распределением электронной плотности – величины пространственного
электрического заряда. «Размазанные» вокруг атома электроны образуют облако, размеры которого увеличиваются с ростом
главного квантового числа n пропорционально n 2. Электронная плотность облака
характеризуется вероятностью обнаружить электрон в данной точке пространства. Для |
В молекуле |
|||||||||||||||||
Молекула NaCl. У атома натрия один валентный электрон, а хлору не хватает одного электрона до заполненной конфигурации.
При сближении атомов Na и Cl валентный электрон атома натрия займет свободное место в атоме хлора. Возникнут
два иона:
Казалось бы, почти все понятно. Но странно – что мешает электронам двух ионов соединиться в одну электронную
систему, двигающуюся вокруг двух ядер? Почему ионы ведут себя, как твёрдые шарики? Конечно, некоторую роль играет то,
что электроны, обладая отрицательным зарядом, отталкиваются друг от друга. Но главное не в этом. Раньше было
рассказано о безумной идее Луи
Описанный способ образования молекул встречается весьма часто. Не будем приводить другие примеры. Они есть в школьных учебниках по химии.
Для характеристики атомов и ионов часто вводят понятие атомного или ионного радиуса, понимая некоторую его условность: шарик такого радиуса не заполнен плотно электронами, но все электроны атома или иона действительно движутся внутри него.
Молекулу удобно представлять как сравнительно жесткую конструкцию, построенную из шариков – атомов и/или ионов.
При этом положения центров шариков, совпадающих с ядрами атомов, можно считать строго определёнными.
 |
 |
|
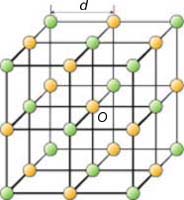
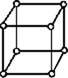
Кристаллическая решётка поваренной соли NaCl представляет собой две кубические решётки с атомами хлора и натрия в узлах, «вставленные» одна в другую. Расстояние между соседними атомами d называется периодом решётки. Решётку можно наращивать до бесконечности, «сдвигая» её ячейки в любую сторону на величину, кратную периоду, от произвольно выбранного центра O. |
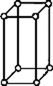
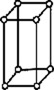
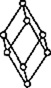
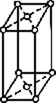
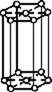
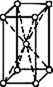
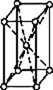
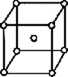
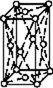
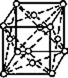
В 1848 году французский исследователь О. Браве выдвинул гипотезу, что кристаллы построены из расположенных в пространстве по определённым законам точек – узлов, в которых находятся атомы. Кристаллические решётки получаются при параллельном переносе (трансляции) атомов. Прямые линии и плоскости, проведённые через узлы решётки, разбивают её на одинаковые ячейки. Всего имеется 14 видов решёток Браве. Они разделяются на 7 систем (сингоний) по формам ячеек и на 4 типа по расположению атомов в них. С их помощью удаётся в первом приближении описать структуру любого кристалла. |
|
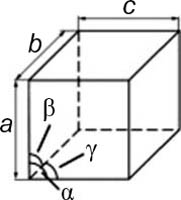
ТРИКЛИННАЯ | МОНОКЛИННАЯ | РОМБИЧЕСКАЯ |
ТЕТРА- ГОНАЛЬНАЯ |
ТРИГОНАЛЬНАЯ (РОМБОЭДРИ- ЧЕСКАЯ) |
ГЕКСА- ГОНАЛЬНАЯ |
КУБИЧЕСКАЯ | ||
|
a ≠ b ≠ c |
a ≠ b ≠ c β ≠ 90° |
a ≠ b ≠ c |
a = b ≠ c |
a = b = c |
a = b ≠ c γ = 120° |
a = b = c |
|||
| ПРИМИТИВНЫЙ | 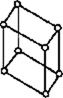 |
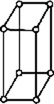 |
 |
 |
 |
 |
|||
|
БАЗОЦЕНТРИРО- ВАННЫЙ |
 |
 |
 |
||||||
|
ОБЪЁМНОЦЕНТРИ- РОВАННЫЙ |
 |
 |
 |
||||||
|
ГРАНЕЦЕНТРИРО- ВАННЫЙ |
 |
 |
МОЛЕКУЛЫ… ЧТО ЖЕ ДАЛЬШЕ?
Пока речь шла только о кирпичиках, из которых состоят все предметы, все биологические объекты и мы сами.
Настоящие кирпичи, конечно, во много раз меньше постройки, на которую они были потрачены. Для кирпичной стены размером 10 × 10 × 0,2 метра понадобится примерно 10 тысяч кирпичей. Вычислить легко, а вот чтобы перебрать столько кирпичей, тратя на каждый одну секунду, нужно около трёх часов.
Размер каждой молекулы в несколько раз превышает размер атома. Пусть для простоты каждая молекула имеет линейные
размеры порядка 1 нанометра (напомним: 1 нм =
Эти оценки помогают представить, как малы размеры атомных частиц по сравнению с окружающими нас предметами, или, как принято говорить, с макроскопическими телами: они состоят из необозримого числа атомов, молекул. Непосредственное наблюдение атомных частиц – заслуга физики XX века.
Когда из кирпичей строят стены, то, как правило, применяют специальные скрепляющие вещества, играющие роль клея. Молекулы, объединяясь в макроскопическое тело, обходятся своими силами. Здесь расхожее выражение «своими силами» имеет буквальный смысл: это всё те же электростатические силы притяжения и отталкивания, правда, усложненные тем, что заряженные частицы собраны в нейтральные образования. Ведь число отрицательно заряженных частиц (электронов) и в атомах и в молекулах строго равно числу положительных частиц (протонов).
Хотя молекулы нейтральны, на больших расстояниях они притягиваются друг к другу всегда, вне зависимости от того, как построены. Состав и структура молекул определяют величину силы притяжения и её зависимость от расстояния между молекулами – обстоятельство очень важное для понимания строения и свойств макроскопических тел. При соприкосновении молекулы отталкиваются. Тоже всегда. Отталкиваются по той же причине, по которой отталкиваются атомы при образовании молекул.
Итак, всё, что мы непосредственно наблюдаем, все предметы и тела состоят из необозримого числа частиц – атомов, молекул, ионов. Мы имеем дело c веществами в разных состояниях. Нагревая, твёрдое тело удаётся расплавить, а жидкость превратить в газ. Охлаждая, этот путь можно пройти в обратном направлении.
При превращении тел из одного состояния в другое с атомами, из которых они построены, как правило, ничего не происходит. Превращение тел – свидетельство изменения только их строения, то есть расположения молекул, атомов и/или ионов в пространстве.
Как же расположены атомные частицы в макроскопических телах?
Наиболее правильно упорядочены молекулы в кристаллах. Правильней было бы сказать – в монокристаллах. В монокристалле у каждой молекулы есть свое место, а весь монокристалл – повторение одной элементарной ячейки.
В природе встречаются небольшие монокристаллы алмазов, аметистов, бериллов и многих других драгоценных камней, но
особенно большими – массой в сотни килограммов – вырастают монокристаллы кварца. Для технических нужд
(оптики, лазерной и радиотехники) их выращивают искусственно. Однако гораздо чаще кристаллы состоят из множества
маленьких монокристалликов – кристаллитов, ориентированных случайным образом. Это – поликристаллы
Во многих твёрдых телах атомы расположены совершенно беспорядочно. Такие тела называют аморфными. Не слишком
удачное название: хотя «аморфный» означает «бесформенный», аморфные тела, как и кристаллические, прекрасно сохраняют
форму
Принцип, заставляющий молекулы конденсироваться в кристалл, тот же, что «руководил» электронами при построении атомов, а атомами – при построении молекул. Система частиц должна обладать энергией меньшей, чем та, которую она имела, когда частицы были друг от друга далеко и потому независимы. Но этого мало. Частицы должны расположиться в пространстве так, чтобы им было «неповадно», чуть сдвинувшись, уменьшить свою энергию. Если бы это условие не было выполнено, частицы не преминули бы действительно сойти со своих мест и уменьшить энергию подобно тому, как скатывается шарик на дно ямки, если его положить на склон.
| ПИРАМИДА | ТРАПЕЦОЭДР | ПРИЗМА | ТЕТРАЭДР | ПЕНТАГОН- ТРИОКТАЭДР |
 |
 |
 |
 |
 |
| ДИПИРАМИДА | СКАЛЕНОЭДР | РОМБОЭДР | ОКТАЭДР |  |
 |
 |
 |
 |
|
|
Некоторые кристаллы имеют довольно простую форму, но их комбинации могут создавать очень сложные многогранники. |
||||
На математическом языке сформулированные условия означают, что энергия системы частиц как функция смещений должна иметь минимум. Положения частиц, при которых энергия их системы минимальна, называют положениями равновесия.
В предыдущем абзаце вместо молекулы мы использовали слово «частицы». Дело в том, что в процессе конденсации (то есть превращения совокупности частиц из газа в жидкость или в твёрдое тело) нередко молекулы распадаются на атомы или ионы. Иногда даже на ионы и электроны (именно так образуются проводники – металлы). Не будем на этом останавливаться. Сосредоточимся на другом – на расположении частиц в пространстве. Каковы их положения равновесия? Каким образом достигается минимум?
Минимум достигается, когда частицы расположены вполне определенным образом. Прежде всего – периодически. Но, конечно, условию минимума энергии удовлетворяет не любое периодическое расположение частиц. Между частицами (молекулами, атомами, ионами) должны быть вполне определенные расстояния.
Повторим: в монокристалле энергия его частиц имеет минимум. Монокристалл состоит из строго повторяющихся одинаковых ячеек. В каждой ячейке несколько атомов. Бывает, что один, а бывает и несколько десятков. Многие кристаллы обладают ячейками правильной формы.
Характерная черта кристалла – дальний порядок. Зная строение одной ячейки, мы тем самым знаем строение всего монокристалла. Как правило, частицы в ячейке кристалла уложены достаточно плотно. Поэтому величина каждой ячейки порядка нескольких десятых нанометра. Ячейки в кристалле плотно упакованы. В этом смысле они действительно напоминают кирпичи. Можно не только наблюдать структуру кристаллов, но и с большой точностью измерить параметры кристаллических ячеек, а также установить расположение атомов в многоатомной ячейке, измеряя углы рассеяния в них рентгеновских лучей. Этим занимается рентгеноструктурный анализ. Использование рентгеновских лучей обусловлено тем, что их длина волны того же порядка, что размеры ячеек кристаллов.
В поликристалле дальний порядок тоже имеет место, но в пределах одного кристаллита. В каждом кристаллите,
конечно, меньше ячеек, чем в большом кристалле, но всё же очень много. Обычно линейный размер кристаллита порядка
В аморфных твёрдых телах атомы расположены так, что дальний порядок отсутствует вовсе. Почему же они самопроизвольно, как шарик со склона, не «сваливаются» в кристаллическое состояние? Этот же вопрос можно задать по поводу поликристаллов. Если бы могли, и аморфные тела, и поликристаллы наверняка превратились бы в монокристаллы. Что же им мешает? Дело в том, что каждая молекула или каждый атом сидит в потенциальной ямке. Во всех случаях существует положение атомов в пространстве, которое энергетически выгоднее (имеет меньшую энергию), чем поликристаллическое или аморфное состояние. Но достичь его можно лишь тогда, когда атомы преодолеют потенциальные барьеры. Иногда это им удаётся. И происходит спонтанная кристаллизация. Её порой удаётся наблюдать на очень старых оконных стеклах, где иногда возникают радужные пятна – это свет преломляется в микроскопических кристалликах, выросших на их поверхности. Но часто барьеры столь велики, что поликристаллическое или аморфное состояние вещества совершенно устойчиво. Из таких материалов можно делать что угодно, не опасаясь, что они спонтанно изменят своё состояние.
В жидкостях нет дальнего порядка. Это позволяет им течь, принимать форму сосуда. Но интересно отметить, что ближний порядок в относительном расположении молекул есть и в жидкости. В любой точке объёма жидкости её молекулы образуют упорядоченную структуру, которая «размывается» на небольшом расстоянии от неё. Этот факт тоже установлен с помощью рентгеноструктурного анализа. Превращение кристалла в жидкость – разрушение дальнего порядка.
ФИЗИКА ТВЁРДОГО ТЕЛА – СПЕЦИАЛЬНЫЙ РАЗДЕЛ ФИЗИКИ
Физика твёрдого тела сумела связать свойства твёрдых тел с их строением и со свойствами частиц, из которых они построены. На эту область физики приходится немалая часть современных физических исследований. Под твёрдым телом понимают именно вещество в твёрдом состоянии. Иногда в руках физиков имеется для исследования крупинка вещества или плёнка толщиной в несколько микрон, а иногда образец столь велик, что его можно считать бесконечным.
При всём различии твёрдых тел их структура похожа. Как уже говорилось, твёрдые тела имеют либо кристаллическую, либо
аморфную структуру. Попробуем представить себе процесс кристаллизации. Пусть для определённости кристалл растёт из
раствора, куда мы поместили затравку. Кристалл растёт слой за слоем, будто подчиняясь
Строение молекул определяет силу притяжения между молекулами, а эта сила – энергию связи между частицами,
энергию, которую нужно придать частице, чтобы отделить её от твёрдого тела. Оценкой энергии связи может служить
температура плавления твёрдого тела. Зависимость температуры
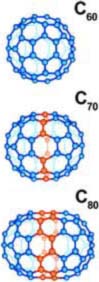
Некоторые вещества встречаются в природе в различных модификациях. Особенно яркий пример – углерод. И алмаз и графит – разные модификации одного и того же углерода. И это отнюдь не все модификации: в 1985 году были открыты и более сложные углеродные молекулы в форме сфер и трубок – фуллерены и тубелены. Физические свойства разных модификаций одного и того же вещества могут кардинально отличаться. Классические примеры: алмаз и графит, белое и серое олово.
Существование веществ в разных формах называется полиморфизмом. Полиморфизм – свидетельство того, как велико влияние на свойства тел взаимного расположения частиц, из которых тело состоит.
Остановимся и просуммируем сказанное.
Вещества состоят из молекул. Построенные из атомов, молекулы бесконечно разнообразны. Одни молекулы состоят из
нескольких атомов: в молекуле
В твёрдом состоянии вещества устроены сравнительно просто.
Почти всё, чем мы пользуемся, создано руками человека. Предметы, устройства, машины и приборы могут быть очень сложными.
Некоторые творения природы бывают удивительно красивы. Все мы неоднократно любовались горами, скалами, бесконечными пляжами, а в минералогических музеях – кристаллами.
И всё же: все тела неживой природы построены из неорганических веществ. Поражающие воображение структуры и самые вычурные творения инженерного искусства – результат комбинации неорганических веществ. А они, неорганические вещества, сравнительно просты по своему устройству. Просты, если их сравнивать с живыми существами.
 |
 |
|
||
|
Чуть больше десяти лет назад были открыты удивительные молекулы углерода
|
ЧАСТИЦЫ, ИЗ КОТОРЫХ ПОСТРОЕНЫ ТВЁРДЫЕ ТЕЛА, ДВИЖУТСЯ
Твёрдые тела стабильны. Камень – символ неизменности. Но и в твёрдом теле не прекращается движение атомных и субатомных частиц. Мы уже знаем, что никогда не прекращается движение электронов в атомах и молекулах, даже когда они находятся в основном состоянии.
Понятие «основное состояние», как имеющее наименьшую возможную энергию, применимо и к твёрдому телу. В основном состоянии его атомы и молекулы не прекращают своего движения. Они колеблются вокруг положений равновесия. Эти колебания называют нулевыми колебаниями, так как происходят даже при нулевой температуре (по абсолютной шкале Кельвина). Нулевые колебания – квантовый эффект: не может частица, обладающая волновыми свойствами, «замереть» в положении равновесия. Это запрещено соотношениями неопределенностей.
Для тяжёлых частиц (атомов, молекул) квантовые эффекты значительно меньше, чем для легких электронов, но они есть. Нулевые колебания – пример квантовых эффектов в движении сравнительно тяжёлых (по сравнению с электронами) частиц.
Особенно впечатляющий пример – гелий. При атмосферном давлении он остаётся жидким вплоть до абсолютного нуля – так проявляются квантовые свойства движения его атомов. Чтобы гелий затвердел, его надо подвергнуть давлению более 26 атмосфер. Нулевые колебания – причина того, что гелий не кристаллизуется при нормальном давлении. Если бы он стал кристаллом, амплитуда нулевых колебаний его атомов превысила бы среднее расстояние между атомами. У других веществ так не бывает. Гелий уникален.
Тепловое движение атомных частиц в твёрдых телах осуществляется в виде колебаний атомов, молекул, ионов – частиц, из которых тело состоит. Частицы, как и в случае нулевых колебаний, колеблются вокруг положений равновесия. Именно эти абстрактные точки – положения равновесия, их расположение строго упорядочено. Если бы можно было сделать мгновенный (буквально!) снимок кристалла, мы убедились бы, что атомы расположены не в точках равновесного положения, а несколько сдвинуты от них – на первый взгляд беспорядочно.
Исследуя строение твёрдых тел, пренебрегать тепловым движением нельзя. С ростом температуры несколько изменяется размер ячейки кристалла, а благодаря этому и размер всего тела. Это явление называется тепловым расширением. Изменение температуры – причина многих количественных изменений параметров тела. Обычно они происходят плавно: немного изменяется температура, немного меняются характеристики твёрдого тела – плотность, электрическое сопротивление, твёрдость.
Но иногда свойства тела изменяются скачком, причём при вполне определённой температуре. Это событие называют фазовым переходом, а температуру, при которой оно произошло, либо температурой фазового перехода, либо критической температурой. Плавление, превращение жидкости в газ, переход металла в сверхпроводящее состояние – примеры фазовых переходов. Критические температуры зависят от давления, от магнитного поля, от концентрации веществ, входящих в тело. Если на осях координат откладывать значение критической температуры как функцию давления, магнитного поля, концентрации, чертёж будет изображать фазовую диаграмму.
При фазовом переходе с кристаллом может произойти одно из двух: либо его структура изменится кардинально, либо
произойдёт лишь незначительное изменение структуры, однако такое, что приведёт к изменению симметрии тела. Иногда в
критической точке появляется или исчезает
Десятилетия теория критических явлений была дразнящей загадкой физики твёрдого тела. Во второй половине XX века основные черты критических явлений были поняты. Теория критических явлений – одна из глав теории макроскопических явлений, или, как часто говорят, теории конденсированного состояния.
Теория конденсированного состояния – разветвлённая наука, использующая весьма сложную экспериментальную технику и не менее сложные теоретические построения. Но, несмотря на непрекращающееся возрастание сложности как теории, так и экспериментальной техники, основные представления о том, из чего построены твёрдые тела, о структурных единицах макроскопических тел не изменяются.
Теория конденсированного состояния исходит из факта, что тела состоят из молекул, те – из атомов, а атомы –
из электронов и атомных ядер – сгустков нуклонов. Теория основывается на понимании поведения коллективов
известных, подробно изученных частиц, свойства которых не надо «подгонять» для объяснения макроскопических явлений.
А они бывают столь удивительными, что до тех пор, пока природа явления не понята, кажется, что его нельзя
объяснить, не снабдив частицы
Один пример – для иллюстрации.
Электрическое сопротивление металлов обусловлено столкновениями электронов на своём пути с микроскопическими препятствиями. И движение электронов под действием электрического поля, и их столкновения описываются либо классической, либо квантовой механикой в зависимости от конкретных условий. Но вот в 1911 году нидерландский физик Г. Камерлиг-Оннес обнаружил, что при критической температуре (при температуре сверхпроводящего перехода) металл теряет сопротивление. Как это может быть? Что произошло? Не изменились ли электроны?
45 лет физики раздумывали над загадочным явлением. Собрали огромный экспериментальный материал. Наконец природа сверхпроводимости в общих чертах была понята. Микроскопическую теорию сверхпроводимости создали три американских физика-теоретика – Дж. Бардин, Л. Купер и Дж. Шрифер (Нобелевская премия 1972 года). Оказалось, что с отдельными электронами при переходе в сверхпроводящее состояние ничего не происходит, но они объединяются в пары, и свойства коллектива электронов кардинально меняются. Фазовый переход металла из нормального в сверхпроводящее состояние – свидетельство изменения свойств не каждого электрона, а всего коллектива электронов, которое, в частности, проявляется в исчезновении сопротивления.
ВСЁ НЕ ТАК ПРОСТО
Твёрдые тела могут разрушаться, а под воздействием внешних условий менять не только свои свойства, но и форму. Но это не мешает ощущению того, что именно твёрдое тело – символ устойчивости, неподвижности.
Неизменность твёрдых тел особенно отчётливо видна при сравнении с биологическими объектами. А ведь и растения, и животные, и мы сами – всё, что составляет живую природу, построено из тех же молекул, атомов, ионов, из которых построены твёрдые тела. В чём же причина такого разительного отличия?
Рассказ об этом должен составить содержание другой статьи.
Но прежде чем расстаться, хочется обратить внимание на некоторое сходство между живой и неживой природой. Повторим: объекты живой природы построены из тех же первичных элементов, что и объекты неживой природы. Какой бы из биологических объектов мы ни разложили на составные части, «по пути» встретив удивительные конструкции, совершенно непохожие на те, из которых построены твёрдые тела, мы в конечном итоге дойдем до протонов, нейтронов и электронов.
Более того, «спускаясь» от биологического уровня до физико-химического, исследуя процессы на молекулярно-атомном
уровне, мы убеждаемся, что там справедливы те же законы, что и в мире неживой природы. Нет
Вернёмся к росту кристаллов. Предположим, в насыщенный раствор поваренной соли опустили миниатюрный кристаллик NaCl. Из раствора начнёт расти её кристалл. Он будет строиться по плану, который зафиксирован в зародыше – кристаллике NaCl. При таком описании рост кристалла напоминает рост биологического организма, план которого заключён в его зародыше. Только план в зародыше неизмеримо сложнее того, который содержит кристаллик поваренной соли. Вот почему этот заключительный раздел назван: «ВСЁ НЕ ТАК ПРОСТО».
***
Рассказал всё, что хотел рассказать. Твёрдые тела встречаются на каждом шагу. Физика твёрдого тела своими результатами питает многие отрасли техники. Множество открытий в физике твёрдого тела сделаны в поисках необходимых технике материалов и свойств. Вполне земная наука.
Зачем же я приглашал вглядеться в звёздное небо? Из электронов, протонов и нейтронов построены отнюдь не только земные объекты. Все бесчисленные миры: наши соседи (Луна, планеты, Солнце), другие звёзды – все они тоже построены из тех же трёх частиц. И, похоже, подчиняются тем законам, которые открыты нами, разумными существами на малютке Земле.
Откуда нам это известно? Конечно, мы можем взять пробы только с самых ближайших соседей по пространству. Изредка прилетают и не сгорают в земной атмосфере метеориты. Любые образцы, попадающие в руки экспериментаторов, подтверждают наше убеждение. Но главное не в этом.
Наблюдения над различными космическими объектами ставило и ставит перед астрофизиками множество задач. Не все они решены, всегда, в любой области развивающейся науки есть задачи, ожидающие своего решения. Но все задачи, которые удалось решить, решены, не выходя за пределы земной физики, если под этим понимать утверждение об электронах, протонах и нейтронах как о строительном материале макроскопических тел и о том, что они подчиняются законам, открытым на Земле.
Как уже говорилось, существует более трёхсот элементарных частиц. По ходу нашего рассказа кроме электронов, протонов и
нейтронов мы упомянули только фотоны,
И самое последнее.
Восхищение и объяснение плохо уживаются. Объяснив, как бы ликвидируешь восхищение. Очень хочется, чтобы, поняв в
общих чертах принципы устройства всего на свете, вы не потеряли способность восхищаться тем, что для создания всего
этого баснословного разнообразия достаточно лишь трёх типов частиц – электронов, протонов и нейтронов.
«Подумаешь, – скажет скептик, – с помощью двух значков (нуля и единицы) можно закодировать любой текст:
скучную инструкцию и прекрасную поэму». Правильно! Но текст, а также любое устройство
Бостон, 2003 г.
|
|
|
|